Podstawy wyrażania stężeń.
Stężenie opisuje ilość substancji rozpuszczonej w określonej objętości roztworu lub w masie rozpuszczalnika.
Możliwości jego wyrażania jest wiele. W praktyce laboratoryjnej używane są molowość, normalność, procent masowy, procent objętościowy, molalność, ułamek molowy, stężenia w ppm i ppb. Dobór formy zależy od:
• rodzaju prowadzonej reakcji,
• wymaganej precyzji,
• specyfiki techniki analitycznej,
• standardów obowiązujących w danej branży.
Stężenie roztworu jest jednym z fundamentalnych parametrów opisujących ich skład chemiczny, sposób przebiegu reakcji oraz warunki analizy ilościowej.
W laboratoriach analitycznych, kontrolnych i przemysłowych właściwe zdefiniowanie stężenia ma kluczowe znaczenie dla poprawności wyników, zgodności z procedurami ISO, GMP oraz z powtarzalnością analiz. W niniejszym artykule przedstawiono dwa często stosowane sposoby wyrażania stężenia —molowość (M) i normalność (N) — omawiając ich definicje, zastosowania, różnice oraz praktyczne przykłady.
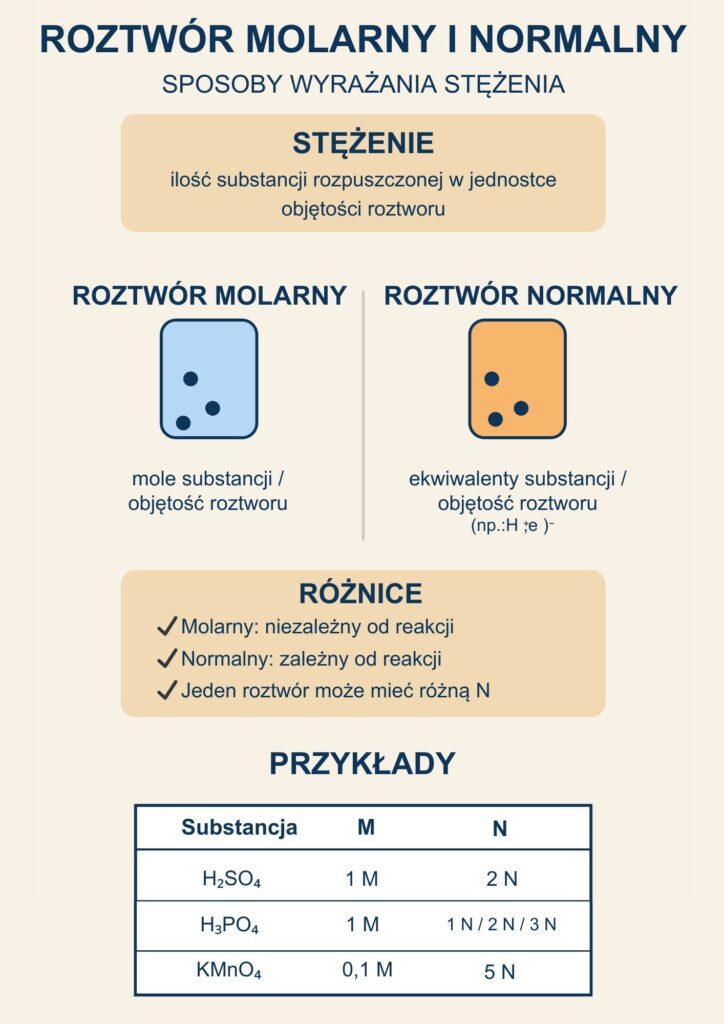
Molowość (M).
Molowość, oznaczana jako M, określa liczbę moli substancji rozpuszczonej w 1 dm³ roztworu.
Jest to najpopularniejsza jednostka stosowana w chemii fizycznej oraz w obliczeniach stechiometrycznych. Jej największą zaletą jest niezależność od rodzaju reakcji. Oznacza to, że roztwór 1 M H2SO4 zawsze zawiera dokładnie 1 mol kwasu na litr roztworu — niezależnie od tego, ile protonów odda w reakcji.
Molowość jest szczególnie przydatna w syntezie, roztworach roboczych oraz technikach instrumentalnych.
Normalność (N)
Normalność, oznaczana jako N, definiuje liczbę gramorównoważników substancji w 1 dm³ roztworu.
Gramorównoważnik to ilość reagentu biorąca udział w reakcji zgodnie z liczbą przenoszonych protonów (H+), elektronów (e–) lub ładunku jonowego. Normalność pozostaje podstawą w klasycznej analizie miareczkowej.
Przykłady substancji o różnej normalności przy tej samej molowości.
- H2SO4 — 1 M = 2 N
- H3PO4 — 1 M = 1–3 N
- KMnO4 — 1 M = 5 N
- Na2CO3 — 1 M = 2 N
- Ca(OH)2 — 1 M = 2 N
Zastosowania w praktyce.
Molowość stosuje się tam, gdzie ważna jest ilość substancji.
Normalność — tam, gdzie substancja odgrywa rolę w przenoszeniu protonów lub elektronów. W miareczkowaniu normalność zapewnia zgodność stechiometryczną.
Porównanie M i N.
- M — wartość stała, niezależna od reakcji
- N — zależna od reakcji i mechanizmu
- M — najlepsza w obliczeniach fizykochemicznych
- N — kluczowa w miareczkowaniu
