| Postać | Bezbarwna oleista ciecz gęstsza od wody |
|---|---|
| Wzór chemiczny | H₂SO₄ |
| Numer WE | 231-639-5 |
| Numer CAS | 7664-93-9 |
| Masa molowa | 98,08 g/mol |
| Rozpuszczalność w wodzie | Miesza się z wodą w każdym stosunku z wydzieleniem dużych ilości ciepła (reakcja egzotermiczna) |
| Temperatura topnienia | -13,6°C |
| Temperatura wrzenia | 296°C |
| Gęstość | 1,840 g/cm³ |
| Inne nazwy/Synonimy | Sulphuric acid, Witriol, Olej szklany |
| ADR/RID | UN 1830, 8(II) |
Kwas siarkowy
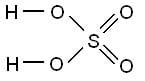
Kwas siarkowy należy do grupy związków nieorganicznych. Określany mianem kwasu tlenowego.
Stężony ma bardzo silne właściwości parzące oraz żrące. Podobnie działa drażniąco na naskórek. Ponadto często mówiąc o kwasie siarkowym używa się określenia krew przemysłu chemicznego. To określenie zawdzięcza temu iż jest używany w wielu gałęziach przemysłu. Co roku produkujemy oraz zużywamy ogromne ilości H2SO4.
Kwas ten możemy otrzymać w przemyśle głównie za pomocą metody kontaktowej. W metodzie tej, możemy wyróżnić trzy podstawowe etapy. Pierwszym etapem jest otrzymanie tlenku siarki, SO2. Następnie następuje utlenienie SO2 do SO3. Z kolei w ostatnim etapie, mamy do czynienia z absorpcją SO w oleum oraz stężonym kwasie siarkowym.
Część otrzymanych w tym procesie produktów rozcieńcza się i zawraca do absorberów. Natomiast reszta stanowi produkt końcowy.
Zastosowanie:
Związek ten może być wykorzystywany również do produkcji innych kwasów, barwników, włókien sztucznych, nawozów sztucznych. Jest to przede wszystkim główny odczynnik przy produkcji akumulatorów kwasowo-ołowiowych, gdzie pełni funkcję elektrolitu.
Kwas siarkowy wykorzystujemy wreszcie w większości laboratoriów chemicznych, np. w syntezie organicznej do sulfonowania bądź nitrowania.






Opinie
Na razie nie ma opinii o produkcie.